Tofacitinib citrát je lék na předpis (obchodní název Xeljanz) původně vyvinutý společností Pfizer pro třídu perorálních inhibitorů Janus kinázy (JAK). Může selektivně inhibovat kinázu JAK, blokovat dráhy JAK/STAT, a tím inhibovat transdukci buněčného signálu a expresi a aktivaci souvisejícího genu, používané k léčbě revmatoidní artritidy, psoriatické artritidy, ulcerózní kolitidy a dalších imunitních onemocnění.
Lék obsahuje tři lékové formy: tablety, tablety s prodlouženým uvolňováním a perorální roztoky. Jeho tablety byly poprvé schváleny FDA v roce 2012 a léková forma s prodlouženým uvolňováním byla schválena FDA v únoru 2016. Je první, která léčí revmatoidní klouby. Yan je inhibitor JAK užívaný perorálně jednou denně. V prosinci 2019 byla opět schválena nová indikace léků s prodlouženým uvolňováním pro středně těžkou až těžkou aktivní ulcerózní kolitidu (UC). Kromě toho byla dokončena současná fáze 3 klinických studií pro ložiskovou psoriázu a probíhá dalších šest klinických studií fáze 3, zahrnujících aktivní psoriatickou artritidu, juvenilní idiopatické artritidy atd. Druh indikací. Výhody tablet s prodlouženým uvolňováním, které mají dlouhodobý účinek a je třeba je užívat pouze jednou denně, přispívají k léčbě a kontrole nemocí pacientů.
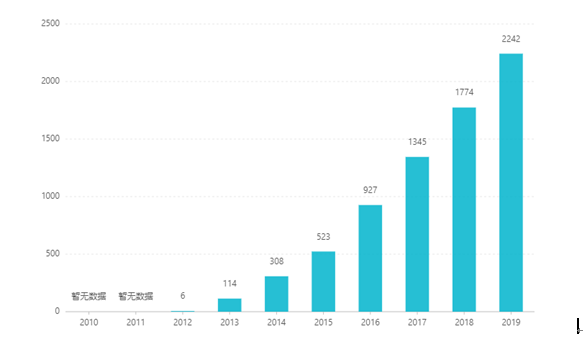
Od uvedení na burzu se její tržby rok od roku zvyšovaly a v roce 2019 dosáhly 2,242 miliardy USD. V Číně byla léková forma ve formě tablet schválena k uvedení na trh v březnu 2017 a v roce 2019 vstoupila do katalogu zdravotního pojištění kategorie B. Poslední vítězná nabídka je 26,79 RMB. Vzhledem k vysokým technickým překážkám přípravků s prodlouženým uvolňováním však tato léková forma dosud nebyla v Číně uvedena na trh.
JAK kináza hraje důležitou roli při zánětech a bylo prokázáno, že její inhibitory léčí některá zánětlivá a autoimunitní onemocnění. Dosud bylo globálně schváleno 7 inhibitorů JAK, včetně Delgocitinibu od Leo Pharma, Fedratinibu od Celgene, upatinibu od AbbVie, Pefitinibu od Astellas, Baritinibu od Eli Lilly a Rokotinibu od Novartisu. Z výše uvedených léků je však v Číně schválen pouze tofacitinib, baritinib a rokotinib. Těšíme se, že „Tofatib citrátové tablety s prodlouženým uvolňováním“ společnosti Qilu budou schváleny co nejdříve a budou přínosem pro více pacientů.
V Číně byl původní výzkumný tofacitib citrát schválen NMPA v březnu 2017 pro léčbu dospělých pacientů s RA s nedostatečnou účinností nebo intolerancí methotrexátu, pod obchodním názvem Shangjie. Podle údajů společnosti Meinenet činil prodej tablet tofacitib citrátu v čínských veřejných zdravotnických zařízeních v roce 2018 8,34 milionu juanů, což bylo mnohem méně než jeho celosvětové prodeje. Velkou část důvodu tvoří cena. Uvádí se, že počáteční maloobchodní cena Shangjie byla 2085 juanů (5 mg*28 tablet) a měsíční náklady byly 4170 juanů, což pro běžné rodiny není malá zátěž.
Nicméně stojí za to oslavit, že tofacitib byl po jednáních v listopadu 2019 zahrnut Národní správou zdravotního pojištění do „Národního základního zdravotního pojištění, pojištění pracovních úrazů a pojištění mateřství“ 2019. Uvádí se, že měsíční poplatek bude snížen na méně než 2 000 juanů po sjednání snížení ceny, což výrazně zlepší dostupnost léku.
V srpnu 2018 vydala Rada pro přezkoumání patentů Státního úřadu pro duševní vlastnictví rozhodnutí o přezkumu č. 36902 žádost o zneplatnění a prohlásila za neplatný základní patent společnosti Pfizertofatib, složený patent, z důvodu nedostatečného zveřejnění specifikace. Patent na krystalovou formu Pfizertofatiib (ZL02823587.8, CN1325498C, datum přihlášky 2002.11.25) však vyprší v roce 2022.
Databáze Insight ukazuje, že kromě původního výzkumu bylo pro uvádění na trh v domácích tabletových formulacích tofacitinibu schváleno pět generických léků Chia Tai Tianqing, Qilu, Kelun, Yangtze River a Nanjing Chia Tai Tianqing. U typu tablet s postupným uvolňováním však pouze původní výzkumná společnost Pfizer podala marketingovou žádost 26. května. Qilu je první tuzemskou společností, která podala marketingovou žádost o tuto formulaci. Kromě toho je CSPC Ouyi ve zkušební fázi BE.
Changzhou Pharmaceutical Factory (CPF) je předním farmaceutickým výrobcem API, hotových formulací v Číně, která se nachází v Changzhou, provincie Jiangsu. CPF byly založeny v roce 1949. Tofacitinib citrátu jsme se věnovali od roku 2013 a již jsme předložili DMF. Zaregistrovali jsme se v mnoha zemích a můžeme vám poskytnout podporu nejlepšími dokumenty pro tofacitinib citrát.
Čas odeslání: 23. července 2021